| Kullanma Talimatı | Nedir Ne İçin Kullanılır |
| Nasıl Kullanılır | Yan Etkileri |
| Eş Değerleri | Dikkat Edilmesi Gerekenler |
| Kısa Ürün Bilgisi | Prospektus |
Kısa Ürün Bilgisi
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
DİVİNA tablet
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Etkin madde :
DİVİNA ambalajı içindeki beher beyaz tablet, 2 mg östrodiol valerat; beher mavi tablet ise 2 mg östradiol valerat ve 10 mg medroksiprogesteron asetat içerir.
Mavi tablette 72 mg, beyaz tablette ise 86.62 mg Laktoz bulunur.
Yardımcı maddeler için 6.1.e bakınız.
Yardımcı maddeler için 6.1.e bakınız.
3. FARMASÖTİK FORMU
Tablet
Beyaz Tablet: Beyaz veya hemen hemen beyaz, 7 mm çapında, yuvarlak ve konveks tablettir. Mavi Tablet: Açık mavi, 7 mm çapında, düz ve konik kenarlı tablettir.
4.1. Terapötik endikasyonlar
Divina tablet;
Östrojen eksikliğine bağlı olan klimakterik arazların tedavisinde; osteoporozun engellenmesinde,
Siklik düzensizliklerde,
Dişi seks hormonunun "yerine konması" gerektiğinde (yumurtalıkların operasyonla alınması gibi), kullanılır.
4.2. Pozoloji ve uygulama şekli
Pozoloji/uygulama sıklığı ve süresi :
DİVİNA; çift fazlı insan menstrüel siklusunu taklit eden bir preparat olduğundan; 11 gün beyaz tablet, günde bir kez olmak üzere (östrojen fazı) ve 10 gün mavi tablet, günde bir kez olmak üzere (kombine östrojen ve progestin fazı) uygulanır.
21 günlük bir tedaviden sonra 7 gün ara verilir ( ilaçsız devre).
Menopoz sonrası hastalar tedaviye hemen başlayabilirken, menopoz öncesi hastaların, siklusun
5. günü DİVİNA kullanmaya başlamaları önerilir.
Hormon replasman tedavisi (HRT) almayan veya sürekli kombine HRT tedavisinden geçiş yapanlarda Divina tedavisi herhangi uygun bir günde başlanabilir.
Siklik veya ardışık HRT tedavisinden geçiş yapanlarda, tedavi bir önceki siklusun tamamlanmasını takip eden gün başlanmalıdır.
Hastalar bir tableti almayı unuttukları takdirde unutulan tablet bir sonraki gün alınmamalıdır. Atlanan tablet ara kanama ve nokta şeklinde kanama gözlenmesini artırabilir.
Postmenopozal semptomların tedavi başlangıcı ve devamında , en düşük etkin doz en kısa sürede kullanılmalıdır.
Uygulama şekli :
İlk gün
Blisterlerin Kontrolü
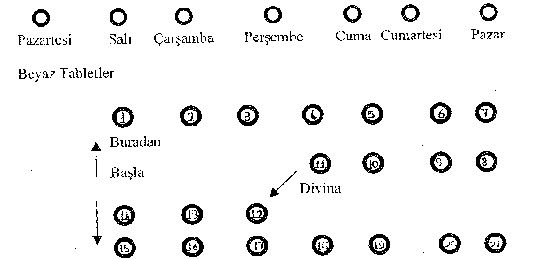
Mavi Tabletler
1. Blister folyonun baskılı yüzünün, en üst bölümünde haftanın günlerini gösteren küçük daireler bulunmaktadır. İlaca başlanan ilk gün o güne ait küçük daire delinir. Bu işlem gerektiğinde ilaca başlanan günü hatırlamak içindir.
2. Menstrüasyon (adet kanaması) mevcut değilse DİVİNAya hemen başlanır. Eğer mevcutsa ilk tablet menstrüasyonun beşinci günü (kanamanın başlangıcından sonraki beşinci gün) alınarak tedaviye başlanır.
3. Bunu izleyen tabletler baskılı blister folyonun üzerinde gösterilen sırayla alınır. Önce ilk gün beyaz tablet; daha sonra 10 gün mavi tablet kullanılıp, bitiminde 7 günlük bir ara verilir. Çoğunlukla, bu ara verme döneminde menstrüasyona benzer bir kanama görülebilir.
4. İkinci kutuya, birinci kutuya başlanan gün başlanır.
DİVİNA tercihen akşam alınır. Unutulduğu takdirde ertesi sabah alınır ve aynı gün akşamı normal doz ile tedavi sürdürülür. Eğer hem akşam hem sabah alınması unutulursa tedaviye normal doz ile devam edilir ancak hafif bir kanama görülebilir.
6. 7 günlük ara sırasında kanama görülebilir.
7. Kutu içerisinde bulunacak olan izleme kartı doldurulup hekime her ziyarette gösterilir.
Özel popülasyonlara ilişkin ek bilgiler : Böbrek/Karaciğer yetmezliği
Eğer karaciğer fonksiyon değerlerinde, anormal yükselmeler, kolestatik ikter ve tromboembolik işaretler görülürse, tedaviye son verilmelidir.
Böbrek fonksiyon bozukluklarında, östrojen negatif etki göstereceğinden kullanılmamalıdır.
Pediyatrik popülasyon:
Çocuklarda kullanımı yoktur.
Geriyatrik popülasyon :
4.3. Kontrendikasyonlar
- Bilinen, şüphelenilen veya geçmişteki meme kanseri
- Bilinen veya şüphelenilen östrojene bağımlı malin tümörler (örneğin, endometrium kanseri)
- Tanı konmamış genital kanama
- Tedavi edilmemiş endometriyal hiperplazi
- Önceki idiyopatik veya mevcut venöz tromboemboli [derin ven trombozu (DVT), pulmoner emboli]
- Aktif veya yakın zamandaki arteriyel tromboembolik hastalık (ör, angina, miyokard infarktüsü)
- Akut ve kronik karaciğer hastalıkları, hamileliğe bağlı ikter ve hepatoz, Dubin Johnson ve Rotors hastalıkları
- Etkin maddelere veya yardımcı maddelerden herhangi birine karşı bilinen aşırı duyarlık
- Porfiri
- Hamilelik
- Serebrovasküler bozukluklar
- Orak hücre anemisi
- Hamilelik herpesi
- Hamilelikte artan otoskleroz
4.4. Özel kullanım uyarıları ve önlemleri
Yakın gözetim gerektiren durumlar:
Divina tedavisi sırasında aşağıdaki rahatsızlıkların nüksedebileceği veya alevlenebileceği
hesaba katılmalıdır:
- Leiomyoma (uterus fibroidi) veya endometriozis
- Tromboembolik bozukluk risk faktörü veya hikayesi
- Östrojene bağımlı tümör risk faktörü, örneğin birinci derece akrabada meme kanseri
- Hipertansiyon
- Karaciğer bozuklukları (ör, adenom)
- Vasküler tutulumu olan veya olmayan diabetes mellitus
- Kolelitiazis
- Migren veya (şiddetli) başağrısı
- Sistemik lupus eritematozus
- Endometriyal hiperplazi hikayesi
- Epilepsi
- Astım
- Otoskleroz
Tedavinin acilen kesilmesini gerektiren durumlar:
Herhangi bir kontrendikasyon durumunda ve aşağıdakilerin varlığında tedavi kesilmelidir:
- sarılık veya karaciğer fonksiyonunda bozulma
- kan basıncında anlamlı artış
- yeni başlayan migren tipi başağrısı
- gebelik
Endometriyal hiperplazi:
- Östrojenler tek başına uzun süre uygulandığında endometriyal hiperplazi ve kanser riski artmaktadır. (bakınız kısım 4.8)
- Histerektomi olmayan kadınlarda en az 12 gün boyunca progesteron eklenmesi riski fazlasıyla azaltır.
- Tedavinin başlangıcında ara kanama ve nokta şeklinde kanama oluşabilir. Ara kanama veya nokta şeklinde kanama, tedaviden bir süre sonra oluşuyorsa veya tedavi kesildikten sonra devam ediyorsa, endometriyal kanser riskini dışlayacak şekilde endometriyal biyopsi ile neden araştırılmalıdır.
Meme Kanseri
- Randomize plasebo kontrollü çalışmalarda, birkaç yıl östrojen, östrojen-progesteron kombinasyonu veya tibolon alan kadınlarda meme kanseri riskinde artış bildirilmiştir. Tüm hormon replasman tedavilerinde, artmış risk birkaç yıl kullanımla belirgin olmakta ve alım süresi ile artmaktadır. Tedavinin sonlanmasını takiben birkaç yıl içinde (en fazla 5. yıl) risk düzeyi başlangıç düzeylerine dönmektedir.
- Milyon Kadın Çalışmasında (WHI), konjuge östrojen veya östradiol ile meme kanseri relatif riski ardışık veya sürekli herhangi bir progesteron ilavesine göre daha fazladır. Farklı uygulama yolları arasında riskde farklılığa ait bir kanıt yoktur.
- Milyon Kadın Çalışmasında, sürekli konjuge östrojen ve medroksiprogesteron asetat kullanımı, plaseboyla karşılaştırıldığında, biraz daha fazla büyük ve daha sık lokal lenf nodu metastazlı meme kanserleri ile ilişkilendirilmiştir. Özellikle östrojen progesteron kombine tedavisi içeren HRT, meme kanserinin radyolojik tanısını olumsuz etkileyecek şekilde mamografik görüntülerde yoğunluğu artırır.
Venöz tromboembolizm
- HRT ile derin venöz tromboz veya pulmoner emboli gibi venöz tromboembolizm gelişiminde daha yüksek relatif risk mevcuttur.
- Venöz tromboembolizm için genellikle tanımlanmış risk faktörleri, aile veya kişi hikayesi, şiddetli obesite (VKİ>30 kg/m2) ve sistemik lupus eritematozusdur. Venöz tromboembolizmde variköz venlerin muhtemel rolü üzerinde konsensus yoktur.
- Venöz tromboembolizm veya bilinen trombofilik durum hikayesi olan hastalarda artmış venöz tromboembolizm riski vardır. HRT bu riski arttırabilir. Tromboembolizm veya reküran spontan abortus öyküsü veya kuvvetli aile öyküsü olan hastalarda trombofilik yatkınlığı dışlamak amacıyla araştırılmalıdır. Trombofilik faktörlerin kapsamlı şekilde araştırılmasına kadar veya antikoagülan tedavi başlanana kadar, bu hastalarda HRT kullanımı kontrendike olarak düşünülmelidir.
- Venöz tromboembolizm riski, uzun süreli hareketsizlik, major trauma veya major cerrahi ile geçici olarak artabilir. Tüm postoperatif hastalarda, cerrahi sonrası venöz tromboembolizmi önlemek için profilaktik yöntemlerin uygulanmasına azami dikkat edilmelidir. Cerrahi sonrası uzamış hareketsizliğin olabileceği durumlarda, mümkünse 4-6 hafta öncesinde geçici olarak tedavinin kesilmesi düşünülmeli ve hasta hareket edene kadar tedavi başlatılmamalıdır.
- Tedavi başlamasını takiben venöz tromboembolizm gelişirse tedavi sonlandırılmalıdır. Hastalar potansiyel tromboembolik semptomları (bacağın ağrılı şişmesi, göğüsde ani ağrı, dispne) gözlemlerse hemen doktoruna başvurmalıdır.
Koroner arter hastalığı
- Randomize klinik çalışmalarda, sürekli kombine konjuge östrojen ve medroksiprogesteron asetat kullanımı ile kardiyovasküler yarar açısından herhangi bir kanıt yoktur. Randomize kontrollü 2 çalışmada kullanımın birinci yılında kardiyovasküler morbiditede muhtemel artış riski göstermiş ve herhangi bir yarar göstermemiştir. Diğer HRT ürünlerinde, kardiyovasküler morbidite ve mortalite üzerine etkilerini inceleyen sınırlı sayıda randomize kontrollü çalışmalar vardır. Bu yüzden, bu bulguları diğer tüm HRT ürünlerine yaygınlaştırmak kesin değildir.
İnme
- Randomize kontrollü bir çalışmada, sağlıklı kadınlarda sürekli kombine konjuge östrojen ve medroksiprogesteron asetat tedavisi sırasında artmış iskemik inme riski gözlenmiştir. Bu artmış riskin diğer tüm HRT ürünlerine kapsayıp kapsamadığı bilinmemektedir.
Over kanseri
- Bazı epidemiyolojik çalışmalarda histerektomi uygulanmış kadınlarda, uzun süreli (en az 5-10 yıl) yalnızca östrojen içeren HRT ürünlerini kullanmak ile o ver kanseri riskinde artış arasında bir ilişki bulmuştur. Uzun süreli kombine HRT ürünlerinin kullanımının farklı bir risk içerip içermediği bilinmemektedir
Diğer rahatsızlıklar:
Östrojenler sıvı tutulmasına neden olabilir, bu nedenle kalp veya böbrek fonksiyon bozukluğu olan hastalar dikkatlice gözlenmelidir. Son dönem böbrek yetmezliği olan hastalar yakından gözlenmelidir, zira Divinadaki etkin maddelerin dolaşımdaki düzeyinin artması beklenmektedir.
Önceden hipertrigliseridemisi olan kadınlar HRT sırasında yakından izlenmelidir, zira bu durumda östrojen tedavisi ile birlikte pankreatite yol açan plazma trigliseridlerindeki çok fazla artışa ait nadir olgular bildirilmiştir.
Östrojenler tiroid bağlayıcı globulini (TBG) artırarak, proteine bağlı iyodür (PBI), T4 düzeyleri (kolon- veya radio-immunoassay ile) veya T3 düzeyleri (radio-immunoassay ile) ile ölçülen dolaşımdaki total tiroid hormonunu artırır. T3 resin içe-alımı azalır ve yüksek TBGyi yansıtır. Serbest T4 ve serbest T3 konsantrasyonları değişmemiştir. Serumda kortikoid bağlayıcı globulin (CBG), seks hormonu bağlayıcı globulin (SHBG) gibi diğer bağlayıcı proteinler de yükselerek, dolaşımdaki sırasıyla kortikosteroidlerin ve cinsiyet steroidlerinin düzeylerini artırır. Serbest veya biyolojik olarak aktif hormon konsantrasyonları değişmemektedir. Diğer plazma proteinleri artabilir (angiotensinojen/renin substratı, alfa-I-antitripsin, seruloplazmin).
Östrojenler ile uzun dönem tedavi, göğüs ve endometriumda malin tümör riskini arttırabilir.
Östrojen tedavisi gören hastalar, klinik jinekolojide ve kanama düzensizliklerinin görüldüğü durumlarda, düzenli muayene edilmelidir. Eğer karaciğer fonksiyon değerlerinde, anormal yükselmeler, kolestatik ikter ve tromboembolik işaretler görülürse, tedaviye son verilmelidir.
Sigara içmek tromboz riskini arttırır. Östrojen tedavisi, ameliyat öncesi kesilmelidir.
Epilepsi, astım, hipertansiyon, kalp ve böbrek fonksiyon bozukluklarında, diabet ve hipertriodizm gibi endokrin düzensizliklerinde, ödem ve migren ile ilgili semptomlarda ve depresyon geçirmiş olanlarda, östrojen negatif etki göstereceğinden kullanılmamalıdır.
Kognitif fonksiyonda iyileşme konusunda kesin bir kanıt yoktur. WHI çalışmasında 65 yaşından sonra sürekli kombine konjuge östrojen ve medroksiprogesteron asetat başlayan kadınlarda muhtemel demans riskinde artışa ait kanıt mevcuttur. Bu bulguların daha genç postmenopozal kadınlara veya diğer HRT ürünlerine uygulanıp uygulanmayacağı bilinmemektedir
Bir mavi tablet 72.00 mg Laktoz içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glikoz-galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
4.5. Diğer tıbbi ürünler ile etkileşimler ve diğer etkileşim şekilleri
Antikonvülsanlar (fenobarbital, fenitoin, karbamazepin) ve anti-infektifler (rifampisin) gibi spesifik olarak sitokrom P450 enzimini uyardığı bilinen ilaçlarla birlikte kullanımında östrojen ve progesteronun metabolizması artabilir.
Tiroid ve karaciğer fonksiyon testleri ile koagülasyon testlerini etkileyebilir.
Güçlü inhibitörler olarak bilinmelerine rağmen, ritonavir ve nelfinavirin buna karşın steroid hormonlar ile birlikte kullanıldıklarında indükleyici özellikler sergilerler. St Johns wort (Hypericum perforatum) içeren bitkisel preparatlar östrojenlerin ve progestagenlerin metabolizmasını indükleyebilir.
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik kategorisi Xdir.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Bugüne kadar yapılmış epidemiyolojik çalışmaların çoğunda; östrodiol valerat ve medroksiprogesteron asetat ile oluşan istem dışı fötal maruziyet, teratojenik veya fötotoksik etkiye yol açmamıştır.
DİVİNA gebelik döneminde kontrendikedir (bkz. kısım 4.3).
Gebelik dönemi
Gebelik döneminde kullanılmamalıdır. Divina kullanım esnasında gebelik oluşursa tedavi hemen kesilmelidir.
Laktasyon dönemi
Östrodiol valerat ve medroksiprogesteron asetatın insan ya da hayvan sütü ile atıldığına ilişkin yetersiz/sınırlı bilgi mevcuttur. Östrodiol valerat ve medroksiprogesteron asetatın süt ile atılmasına yönelik fizikokimyasal ve eldeki farmakodinamik/toksikolojik veriler nedeniyle memedeki çocuk açısından bir risk olduğu göz ardı edilemez. DİVİNA emzirme döneminde kullanılmamalıdır.
Üreme yeteneği /Fertilite
4.7. Araç ve makine kullanımı üzerindeki etkiler
4.8. İstenmeyen etkiler
Advers etkiler daha sıklıkla tedavinin ilk aylarında oluşur. Tedavi edilen hastalarda advers etki bildiren hastaların genel oranı %15-20dir. Bu yan etkiler genellikle hafiftir ve tedavinin devamı sırasında azalmaktadır. Baş ağrısı ve meme hassasiyeti klinik çalışmalarda hastaların %10undan fazlasında gözükmektedir.
Östrodiol valerat ve medroksiprogesteron asetat ile gözlenen yan etkiler, vücut sistemlerinde aşağıdaki gibi sınıflandırılmıştır, çok yaygın (>1/10); yaygın (>1/100 ila <1/10); yaygın olmayan (>1/1000 ila <1/100); seyrek (>1/10.000 ila <1/1.000); çok seyrek (<1/10.000), bilinmiyor (eldeki verilerden hareketle tahmin edilemiyor)
Kan ve lenf sistemi hastalıkları
Yaygın olmayan: antikoagülasyon faktörlerinde değişiklikler
Metabolizma ve beslenme hastalıkları
Yaygın: kilo artışı
Psikiyatrik hastalıklar
Yaygın olmayan: libido ve ruh hali değişmesi
Sinir sistemi hastalıkları
Yaygın: baş ağrısı Yaygın olmayan: migren
Göz hastalıkları
Yaygın olmayan: görme bozuklukları
Vasküler hastalıkları
Seyrek: venöz tromboemboli
Gastrointestinal hastalıkları
Yaygın: bulantı
Hepato-bilier hastalıkları
Yaygın olmayan: serum karaciğer enzim konsantrasyonlarında değişiklikler
Üreme sistemi ve meme hastalıkları:
Yaygın: meme hassasiyeti, ara kanama
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıkları
Yaygın: Ödem, yorgunluk
Çok sayıda epidemiyolojik çalışma ve randomize plasebo kontrollü çalışmanın (WHI) ışığında, HRT kullanan veya daha önceden kullanmış olanlarda HRT kullanım süresinin uzaması ile meme kanseri riski artmaktadır.
Östrojen ve progesteron ile kombine HRT için bazı epidemiyolojik çalışmalar tek başına östreojen kullanımına göre meme kanserinde daha yüksek risk bildirmiştir.
Uterusu sağlam kadınlarda, endometriyal hiperplazi ve endometriyal kanser riski östrojenin kullanım süresi ile artmaktadır. Epidemiyolojik çalışmaların ışığında, HRT kullanmayan kadınlarda risk için en iyi tahmin 50-65 yaş arası kadınlarda her 1000 kadından 5inde endometriyal kanser beklenmektedir. Tedavi süresi ve östrojen dozuna bağlı olarak östrojen kullananlarda endometriyal kanser riski hiç kullanmayanlara göre 2-12 kat artmaktadır.
Östrojen/progestagen tedavisi ile bildirilmiş olan diğer advers reaksiyonlar:
- Östrojene bağımlı benin ve malin neoplazmalar, ör, endometrium kanseri
- Derin bacak veya pelvis venöz trombozu ve pulmoner emboli gibi venöz tromboemboli, HRT kullanıcıları arasında kullanmayanlara göre daha sıktır. Daha fazla bilgi için 4.3 ve 4.4e bakınız.
- Miyokard infarktüsü ve inme
- Mesane hastalıkları
- Deri ve deri altı dokusu rahatsızlıkları: kloasma, eritema multiforme, eritema nodosum, vasküler purpura.
4.9. Doz aşımı ve tedavisi
Östrojenin aşırı dozu bulantı, baş ağrısı yapabilir ve kadınlarda çekilme kanamasına neden olabilir. Aşırı doz, östrojen ve progesteronun genç çocuklarda kullanılması ile ilgili ciddi hasta etkileri belirtilmemiştir. Tedavi gerekirse semptomatik olabilir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik Grup: Projestojenler ve östrojenler (sıralı preparatlar) ATC Kodu: G03FB06
Sentetik 17P-östradiol olan östradiol valerat, kimyasal ve biyolojik olarak endojen insan östradiolünün aynısıdır. Menopozal kadınlarda östrojen üretim kaybında kullanılır ve menopozal semptomları hafifletir.Östrojen menopoz veya overektomi sonrası gözlenen kemik kaybını önler. Östradiol valerat etkisini östrojen duyarlı dokularda spesifik sitoplazmik reseptörlere bağlanarak gösterir.
Medroksiprogesteron asetat, doğal progesteronun 17-a-hidroksi-6 metilprogesteron türevidir.Medroksiprogesteron asetat endometriyum üzerinde proliferatif fazı sekretuvar faza değiştirerek ve progestin spesifik reseptörlere bağlanarak etkisini gösterir.
Östrojenler,endometriyumun büyümesini uyardığından, östrojen kullanımı endometriyal hiperplazi ve kanser riskini artırmaktadır. Histerektomi yapılmamış kadınlarda progesteron ilavesi östrojen ile uyarılmış endometriyal hiperplazi riskini azaltır fakat ortadan kaldırmaz.
Klinik bilgi
Kanama vakaları ve östrojen yetersizliği semptomlarının hafifletilmesi
Menopozal semptomların hafifletilmesi tedavinin ilk haftalarında meydana gelir. Çekilme kanaması kadınların %86sında 5 günlük süre içinde oluşur. Çekilme kanaması genellikle kombinasyon tableti olarak 2 mg östradiol valerat+10 mg medroksiprogesteron asetat ile olan peryottan 2-3 gün sonra başlar. Ara kanama ya da lekelenme kadınların yaklaşık %24ünde terapinin ilk üç ayında, %34ünde 10-12. aylarda görülür. Amenore ise tedavinin ilk yılı sırasında kadınların %10unda oluşur.
Osteoporozun önlenmesi
Menopoz kemik döngüsünde artış ve kemik kütlesinde azalmayla ilişkilidir. Östrojenin kemik mineral yoğunluğu üzerindeki etkisi doz bağımlıdır. Koruma tedavi devam ettiği sürece etkindir. HRTnin kesilmesi sonrası kemik kütlesi, tedavi uygulanmamış kadınlardakine yakın oranda kaybolur.
5.2. Farmakokinetik özellikler
Emilim : Östradiol oral uygulama sonrası iyi emilir. Östradiol 6,7 saat içinde maksimum plazma düzeylerine ulaşır. 2 mg dozdan sonra (çoklu doz çalışması) Cmaks yaklaşık 234 pmol/ldir. Medroksiprogesteron asetat, gastrointestinal kanaldan iyi absorbe edilir. Divina uygulanmasını takiben MPA maksimum plazma konsantrasyonuna 2,9 saatte ulaşır. 10 mg dozu takiben C maks yaklaşık 720 pg/mldir.
Dağılım : Östradiol dolaşımda, seks hormonuna bağlanan globulinlerine ve albumine bağlı olarak bulunur. Medroksiprogesteron tablet emilimi takiben dolaşımdan eksravasküler dokulara süratle dağılır.
Biyotransformasyon : Serbest östradiol karaciğerde metabolize edilerek, kısmen daha az aktif olan östron olan östrojenlere çevrilir.Medroksiprogesteron asetat karaciğerde metabolize edilir.
5.3. Klinik öncesi güvenlilik verileri
Östradiol ve medroksiprogesteron asetat ile yapılmış hayvan çalışmaları, beklenen östrojenik ve gestajenik etkiler göstermiştir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Her bir Mavi Tablet; Laktoz
Mısır Nişastası İndigokarmin (E 132) Jelatin
Polivinilpirolidon K 25
Pürifiye Su
Talk
Magnezyum Stearat
Her bir Beyaz Tablet;
Mısır Nişastası
Jelatin
Pürifiye Su
Talk
6.2. Geçimsizlikler
Bildirilmemiştir
6.3. Raf ömrü
6.4. Saklamaya yönelik özel tedbirler
6.5. Ambalajın niteliği ve içeriği
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller "Tıbbi Atıkların Kontrolü Yönetmeliği" ve "Ambalaj ve Ambalaj Atıkları Kontrolü Yönetmeliği"ne uygun olarak imha edilmelidir.
