| Kullanma Talimatı | Nedir Ne İçin Kullanılır |
| Nasıl Kullanılır | Yan Etkileri |
| Eş Değerleri | Dikkat Edilmesi Gerekenler |
| Kısa Ürün Bilgisi | Prospektus |
Kısa Ürün Bilgisi
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
CLENİD 160 mcg inhalasyon için ölçülü dozlu aerosol
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Hastaya ulaşan her doz (ağız parçasından çıkan doz): 160 mcg Siklesonid içerir.
Dehidrat alkol 4,320 mg
Yardımcı maddeler için 6.1.e bakınız.
Yardımcı maddeler için 6.1.e bakınız.
3. FARMASÖTİK FORMU
İnhalasyon için ölçülü dozlu aerosol.
Alüminyum inhaler kabı içinde basınçlı propellant gaz ile doldurulmuş süspansiyon. Alüminyum konteynere bir dozaj lama valf eklidir.
4.1. Terapötik endikasyonlar
Astımın tüm basamaklarında antienflamatuar, bronkodilatör, semptom kontrolü ve oral steroid ihtiyacını azaltmak amaçlı kullanılır.
4.2. Pozoloji ve uygulama şekli
Pozoloji:
12 yaş ve üzeri yetişkinler:
CLENİDin önerilen başlangıç dozu günde 1 kez uygulanan 160 mikrogramdır. Bununla birlikte astım belirtilerinin şiddetlendiği hastalarda CLENİD dozunun arttırılması gerekebilir. Günde iki kez 320 mikrogram verilmek üzere, 640 mikrogram/güne kadar yükseltilebilir. Ancak yüksek dozların 3 aydan daha uzun süre kullanımını doğrulayan veri yoktur. Bazı hastalar için etkin idame dozu olarak günde 1 kez 80 mikrogram da tercih edilebilir.
6-11 yaş arası çocuklar:
CLENİDin önerilen başlangıç dozu, persistan astım tedavisinde astım şiddetine bağlı olarak günde 80-160 mikrogramdır. Astım kontrolünün sağlandığı en düşük doz ile idame edilmelidir. Tam doz kişisel yanıta göre belirlenmelidir.
Uygulama sıklığı ve süresi:
Günde bir kez sabah veya akşam kullanılır. Hastalann CLENİDi günün hangi saatinde (akşam ya da sabah) kullanacaktan konusundaki son karar hekim tarafından belirlenmelidir.
Hastalık semptomları CLENİD ile tedaviye başlandıktan sonraki ilk 24 saat içinde düzelmeye başlar. Astım kontrol altına alındıktan sonra CLENİDin dozu hastanın bireysel durumuna göre şekillendirilir ve hastalığın iyi bir şekilde kontrol edilebileceği minimum idame dozu tercih edilir.
Astım yakınmaları şiddetli olan hastalarda akut atak riski mevcut olup bu hastaların akciğer fonksiyon testleri de dahil olmak üzere muayenelerini düzenli şekilde sürdürmeleri gerekir. Astım semptomlarını gidermeye yönelik kısa etkili bronkodilatör kullanımının artışı hastalığın kontrolünde bozulma olduğuna işaret eder. Kısa etkili bronkodilatör kullanımının hastaya sağladığı rahatlama azalmış ise ya da eskisinden daha fazla sayıda inhalasyona ihtiyacı söz konusu olmaya başladıysa hekime başvurulması zorunludur.
Bu durumda hastanın antiinflamatuar tedavinin arttırılması yönündeki ihtiyacı göz önünde bulundurularak tekrar değerlendirilmesi gerekir (örn. CLENİD dozunun arttırılması ya da oral kortikosteroid tedavisine geçilmesi). Ciddi astım alevlenmeleri olağan şekilde tedavi edilmelidir.
Uygulama şekli:
CLENİD, sadece inhalasyon yolu ile uygulanır.
İnhalasyon spreyinin doğru kullanımı doktor veya eczacı tarafından hastaya gösterilmelidir. İnhalasyon sırasında hastalar tercihen oturmalı veya ayakta durmalıdır. İnhalasyon spreyi dik konumda kullanım için tasarlanmıştır.
İnhalasyon spreyinin doğru kullanımı için aşağıda verilen kuralları dikkatle izleyiniz.
inhalasyon spreyinin kullanım talimatı
İnhalasyon spreyinin test edilmesi:
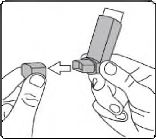
İlk kez kullanımdan önce hastalar ağızlık kapağını, kapağın yanlarından hafifçe sıkarak çıkarmalı, inhalasyon spreyini iyi bir şekilde sallamak, baş parmak ağızlığın altında inhalasyon spreyinin tabanında olacak şekilde parmaklar ve baş parmak arasında tutmalı ve boşluğa sıkım yapmalıdır. İnhalasyon spreyi her sıkımdan önce sallanmalıdır.
İnhalasyon spreyi bir hafta veya daha uzun süre kullanılmadığında hastalar ağızlık kapağını çıkarmalı, inhalasyon spreyi ile boşluğa iki kez sıkım yapılmalıdır.
İnhalasyon spreyinizi kullanacağınız zaman oturunuz veya ayakta dik durunuz.
1. İlk resimde gösterildiği gibi ağızlık kapağını çıkarınız. Ağızlığın temiz olduğundan emin olmak için içini ve dışını kontrol ediniz.
2. İnhalasyon spreyinizi her kullanımdan önce iyice çalkalayınız.
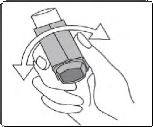
3. İnhalasyon spreyinizi baş parmağınız ağızlığın altında, inhalasyon spreyinizin tabanında olacak şekilde dik tutunuz.
4. Ağızlığı dişlerinizin arasına koyunuz ve dudaklarınızı sıkıca kapatınız.
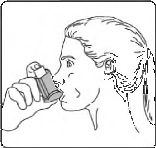
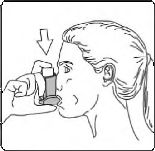
6. Nefesinizi yaklaşık 10 saniye veya rahatça tutabildiğiniz kadar tutunuz ve ağızlığı ağzınızdan çıkarıp parmağınızı inhalasyon spreyinizin üst kısmından çekiniz. Sonra yavaşça ağzınızdan nefes veriniz. İnhalerin içine nefes vermekten kaçınız.
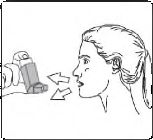
5. Ağzınızdan yavaş ve derin nefes alınız ve aynı anda bir puf doz boşaltmak için inhalasyon spreyinizin üst kısmına basınız.
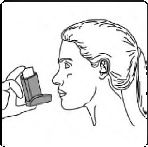
7. Her bir puf ilaç alımı arasında yaklaşık yarım dakika bekleyiniz ve sonra 2-6. basamakları tekrarlayınız.
8. Daha sonra, ağzınızı su ile çalkalayınız ve tükürünüz. Bunu yapmanız ağzınızda pamukçuk oluşumunun ve ses kısıklığının önlenmesine yardımcı olmak için önemlidir.
9. Kullanımdan sonra tozdan korumak için ağızlığın kapağını hemen kapatınız. Ağızlık kapağı doğru bir şekilde yerleştirildiğinde tam yerine oturacaktır. Eğer yerine oturmuyorsa, ağızlık kapağını diğer yöne çeviriniz. Çok fazla güç uygulamayınız.
Hastalar 4, 5 ve 6. basamakları hızlı bir şekilde yapmamalıdır. Hastalann inhalasyon spreyini etkin hale getirmeden hemen önce mümkün olduğunca yavaş bir şekilde nefes almaya başlaması önemlidir. Hastalar aynanın önünde ilk birkaç uygulama için pratik yapmalıdırlar. Eğer hastalar inhalasyon spreyinin üstünden veya ağızlarının yanından buhar geldiğini görürse, 2. basamaktan itibaren uygulamaya tekrar başlamalıdırlar.
İnhalasyon spreyinin temizlenmesi
İnhalasyon spreyinizi haftada en az bir kez temizleyiniz.
1. Ağızlık kapağını çıkarınız.
2. Tüpü plastik gövdeden çıkarmayınız.
3. Kuru bir bez veya kumaş ile ağızlığın içini ve dışını ve plastik gövdeyi siliniz.
4. Ağızlık kapağını doğru bir şekilde yerleştiriniz. Kapağı yerleştirmek için çok fazla güç uygulamayınız.
İnhaler cihazını aktive ederken eş zamanlı olarak nefes alma işlevini ayarlamada zorlanan hastalann ihtiyaçları da göz ardı edilmemelidir; bu gibi durumlarda CLENİD uygun bir hava odacığı (spacer) yardımı ile kullanılabilmektedir.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek/Karaciğer yetmezliği:
Karaciğer yetmezliği olan hastalarda doz ayarlaması gerekmez.
Ancak, ağır karaciğer yetmezliği ve böbrek yetmezliğinde ilaç dozuna ilişkin yeterli veri bulunmamaktadır.
Pediyatrik popülasyon:
Siklesonidin 6 yaş altındaki çocuklann tedavisinde kullanımına ilişkin veriler yeterli olmadığından bu yaş grubuna önerilmez.
Geriyatrik popülasyon:
4.3. Kontrendikasyonlar
CLENİD, siklesonide ve içeriğindeki bileşenlerden herhangi birine karşı aşırı duyarlılığı olduğu bilinen kişilerde kontrendikedir.
4.4. Özel kullanım uyarıları ve önlemleri
Diğer tüm inhale kortikosteroidler gibi, CLENİD de, status astmatikus ve diğer yoğun bakım gerektiren acil durumların tedavisinde endike değildir.
Diğer tüm inhale kortikosteroidler gibi, CLENİD de, inhale kısa etkili bir bronkodilatörün gerekli olduğu akut astım semptomlarının giderilmesi amacıyla kullanılamaz. Hastalara bu gibi acil durumlara uygun ilaçlan hazır bulundurmaları gerektiği konusunda bilgi verilmelidir.
İnhale kortikosteroidlerin özellikle yüksek dozda ve uzun süreli kullanımlarında sistemik etkileri ortaya çıkabilmektedir. Ancak, oral yoldan kullanılan kortikosteroidlere kıyasla bu gibi durumlann meydana gelme ihtimali çok daha azdır. Olası sistemik etkilerin arasında böbrek üstü bezi salgısında azalma, çocuk ve genç ergenlerde büyüme geriliği, kemik mineral yoğunluğunda azalma, katarakt ve glokom gibi durumlar yer almaktadır. Bu yüzden inhale kortikosteroid dozunun astım kontrolünü sağlayabilen en düşük etkin dozuna ayarlanmış olması önem taşımaktadır.
İnhale kortikosteroidlerle uzun süre tedavi olan çocukların ve ergenlik çağındaki hastalann boylannın düzenli olarak ölçülmesi önerilir. Eğer büyüme yavaşsa, inhale kortikosteroid dozunun astımı kontrol altına alabilecek etkili en düşük doza azaltılması amacıyla tedavi tekrar düzenlenmelidir.
Herhangi bir girişim öncesinde bu hastaların böbrek üstü bezi yetersizliği açısından uzman gözetimine alınması gerekebilir. Böbrek üstü bezindeki bozulmanın kalıntıları olabileceği göz önüne alınarak tıbbi ya da cerrahi aciller veya stres oluşturan planlı girişimler söz konusu olduğunda bu hastalara uygun kortikosteroid tedavisine başlanmalıdır.
Oral kortikosteroid kullanan hastalarda inhale siklesonid tedavisine geçilmesi hakkında:
Oral steroid bağımlı hastaların siklesonid tedavisine geçilmesi ve bu hastaların daha sonraki tedavileri özel bakım gerektirir; çünkü uzun süren sistemik kortikosteroid kullanımı nedeniyle böbrek üstü bezi fonksiyonlarındaki bozukluğun iyileşmesi uzun zaman alabilir.
Uzun süredir ya da yüksek dozda sistemik steroid kullanmış olan hastalann böbrek üstü bezi fonksiyonlan baskılanmış olabilir. Bu hastaların böbrek üstü bezi fonksiyonlan düzenli olarak kontrol edilerek, kullandıktan sistemik steroidin dozu dikkatle azaltılmalıdır.
Sistemik steroidin kademeli bir şekilde bırakılması amacıyla mevcut doz her hafta 1 mg prednizolon veya diğer türevlerin buna eşdeğer olacak miktarı şeklinde hesaplanarak azaltma süreci başlatılır. Prednizolon idame dozunun günlük 10 mgı aştığı olgularda daha büyük dilimler halinde haftalık azalışlar da uygun olabilir.
Bazı hastalar bu kademeli bırakma aşamalarında solunum fonksiyonları değişmediği ve hatta düzeldiği halde kendilerini bir şekilde kötü hissetmektedir. Bu gibi hastaları eğer böbrek üstü bezi yetmezliğine ait objektif bulguları yoksa, inhale siklesonid kullanmaya ve de sistemik steroid tedavisini bırakmaya azimle devam etmeleri konusunda cesaretlendirmek gerekir.
Böbrek üstü fonksiyonlan hala düzelmemiş olan oral steroid tedaviden inhale siklesonid tedavisine geçilmiş hastaların stres dönemlerinde (örn. astım ataklarının sıklaşması, torakal enfeksiyonlar, araya giren ciddi hastalık, cerrahi girişim, travma, vb.) ilave sistemik steroid kullanmalannın gerekli olduğunu belgeleyen uyan/bilgi kartlarını taşımalan gerekir.
Sistemik steroid tedavisinin yerine inhale tedavinin başlatılması bazen aleıjik rinit ya da egzama gibi evvelce sistemik ilaç ile kontrol edilmiş bulunan alerjileri açığa çıkarabilir.
4.8. İstenmeyen etkiler
CYP3A4, in vitro verilere göre, siklesonidin aktif metaboliti olan Mlin metabolizmasından sorumlu en önemli enzimdir.
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik kategorisi C.
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Henüz gebe kadınlarda yapılmış yeterli ve iyi kontrol edilmiş çalışma mevcut değildir.
Hayvan çalışmalarında glukokortikoidlerin malformasyonlara sebep olduğu gösterilmiştir (bkz. 5.3. Klinik öncesi güvenlilik verileri). Ancak, bu sonuçların insanlara önerilen dozlarda oluşabilmesi mümkün görünmemektedir.
Diğer glukokortikoidler gibi, siklesonidi de gebelik sırasında ancak fetüs için olan potansiyel riskinin anneye sağladığı potansiyel fayda tarafından karşılanması durumunda kullanmak gerekir. Yeterli astım kontrolünü sağlayabilen en düşük etkin siklesonid dozu kullanılmalıdır. Gebeliği sırasında kortikosteroid kullanmış olan annelerin bebekleri, hipoadrenalizm açısından dikkatle izlenmelidir.
Gebelik dönemi
Diğer glukokortikoidler gibi, siklesonidi de gebelik sırasında ancak fetüs için olan potansiyel riskinin anneye sağladığı potansiyel fayda tarafından karşılanması durumunda kullanmak gerekir. Yeterli astım kontrolünü sağlayabilen en düşük etkin siklesonid dozu kullanılmalıdır.
Laktasyon dönemi
İnhale siklesonidin anne sütüne geçişi hakkında bilgi mevcut değildir. Bebeğini emziren annelere siklesonid tedavisine ancak anneye sağlayacağı faydanın bebeğe getireceği olası riski aşması durumunda başlanmalıdır.
Üreme yeteneği/Fertilite
4.7. Araç ve makine kullanımı üzerindeki etkiler
4.8. İstenmeyen etkiler
Siklesonidin ve siklesonid ile tedavi edilen hastalarda bildirilen reaksiyonları içeren istenmeyen etkilerin sıklığı aşağıda listelenmiştir. Siklesonid ile gözlemlenen etkiler genellikle doz veya konsantrasyona bağlıdır.
4.8. İstenmeyen etkiler
aşağıdaki kategorilere göre listelenmiştir:
Çok yaygm : > 1/10
: > 1/100 ila < 1/10
: > 1/1.000 ila < 1/100
: > 1/10.000 ila < 1/1.000
: < 1/10.000
Yaygm
Yaygm olmayan
Seyrek
Çok seyrek
Enfeksiyonlar ve enfestasyonlar
Yaygm olmayan : Oral mantar enfeksiyonları1
Psikiyatrik hastalıklar
Bilinmiyor : Psikomotor hiperaktivite, uyku bozuklukları, anksiyete,
depresyon,
(özellikle
agresif davranış sergileme, davranış değişiklikleri çocuklarda)
Bağışıklık sistemi hastalıkları
Seyrek : Anjiyoödem, hipersensitivite
Sinir sistemi hastalıkları
Yaygm olmayan : Baş ağrısı*
Kardiyak hastalıklar
Seyrek : Palpitasyonlar2
Vasküler hastalıklar
Seyrek : Hipertansiyon
Solunum, göğüs bozuklukları ve mediastinal hastalıklar
Yaygm olmayan : Paradoksikal bronkospazm*, inhalasyon sonrası öksürük*, disfoni
Gastrointestinal hastalıklar
Yaygm olmayan : Bulantı*, kusma*, kötü tat
Seyrek : Karın ağrısı*, dispepsi*
Deri ve deri altı doku hastalıkları
Yaygm olmayan : Egzama, döküntü
Genel bozukluklar ve uygulama bölgesine ilişkin hastalıklar
Yaygm olmayan : Uygulama bölgesinde reaksiyon ve kuruluk
Uygulamadan hemen sonra, tüm inhale ilaçlarda olan non-spesifık akut bir reaksiyon olarak, etkin madde, yardımcı madde veya ölçülü doz inhalerlerde buhar soğumasından kaynaklanabilen paradoksikal bronkospazm meydana gelebilir. Ciddi durumlarda CLENİD tedavisinin durdurulması düşünülmelidir.
4.9. Doz aşımı ve tedavisi
Akut: Tek doz halinde 2880 mikrogram siklesonid inhale etmiş sağlıklı gönüllüler tarafından oldukça iyi tolere edilmiştir.
İnhale siklesonid aşırı dozunu takiben oluşabilecek akut toksik etki potansiyeli düşüktür. Akut doz aşımı söz konusu olduğunda hastaya özgün bir tedavi uygulamak gerekli değildir.
Kronik: Siklesonidin 1280 mikrogram dozundaki uzun süreli kullanımında böbrek üstü bezinin baskılanması ile ilişkili klinik bulgulara rastlanmamıştır. Bununla birlikte, önerilen dozun aşıldığı uzun süreli kullanımlarda böbrek üstü bezinin bir miktar baskılanma ihtimali dışlanamaz. Bu durumda hastadaki böbrek üstü bezi rezervinin denetlenmesi gerekebilir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Obstrüktif solunum yolu hastalıklarında kullanılan diğer ilaçlar (i nhal eri er)/Glukokorti koi dİ er ATC kodu: R03BA08
Siklesonidin vücuttaki glukokortikoid reseptörlerine bağlanma afınitesi düşüktür. Ağızdan inhalasyon yoluyla uygulanan siklesonid akciğer dokusuna ulaştıktan sonra enzim aracılığı ile esas metaboliti olan C21-des-metilpropionil-siklesonide (Ml) dönüşür. Siklesonidin aktif metaboliti olan C21-des-metilpropionil-siklesonid güçlü lokal antiinflamatuar etkinliğe sahiptir.
Klinik etkinlik
Yapılan klinik çalışmalarda siklesonidin, yetişkinlerde 640 mikrogram dozlarda maksimal etkilerin gözlendiği aşırı duyarlı hastalardaki adenozin monofosfat ve metakoline bağlı hava yolu duyarlılığını azalttığı gösterilmiştir. Farklı bir çalışmada ise 7 gün süreyle siklesonid uygulanıp ardından inhale alerjen verilen grubun erken ve geç dönem hava yolu reaksiyonlarında anlamlı azalma sağlandığı saptanmıştır. İnhale siklesonid tedavisinin hastalann akciğer sekresyonlarındaki inflamatuar hücre (total eozinofil) ve inflamatuar mediyatör artışını azalttığı da gösterilmiştir.
26 erişkin astımlı hastada yapılan kontrollü çalışmada 7 gün süreyle siklesonid tedavisinden sonraki plazma kortizol EAA (konsantrasyon-zaman eğrisi altındaki alan) değerlerinin 24 saatlik takipleri yapılmıştır. Plasebo ile kıyaslamalı olan bu çalışmada siklesonidin 320, 640 ve 1280 mikrogram/gün gibi muhtelif dozları plazma kortizol düzeyinin 24 saatlik ortalamalannda istatistiksel açıdan anlamlı düşüşe sebep olmadığı gibi, doza bağımlı bir etki de gözlenmemiştir.
164 adet erişkin erkek ve kadın astımlı hastanın katıldığı bir klinik çalışmada siklesonid 12 hafta süreyle 320 ya da 640 mikrogram/gün dozunda uygulanmıştır. 12. haftanın sonunda hastalara 1 ya da 250 mikrogram kosintropin uygulanmış ve plasebo kullanan gruba kıyasla plazma kortizol düzeylerinde anlamlı değişiklik gözlenmemiştir.
Erişkin, ergen ve çocuklarda, 12 hafta süren, çift kör ve plasebo kontrollü birçok çalışmada siklesonid ile tedavinin hastaların akciğer fonksiyonlarında sağladığı düzelme ölçülen FEVı ve doruk ekspiryum akım hızı değerleri ile gösterilmiş olup astım semptomlarının kontrolündeki gelişmenin yanı sıra hastalann inhale beta-2 agonist ihtiyacında azalma sağlanmıştır.
Daha önce günde 500-1000 mikrogram flutikazon propiyonat veya eşdeğeri verilen 680 şiddetli, 12 yaş ve üzeri astım hastası ile yapılan 12 haftalık bir çalışmada, 160 veya 640 mikrogram siklesonid tedavisi sırasında hastaların sırasıyla %87,3 ve %93,3ünde alevlenme görülmemiştir. 12 haftalık çalışmanın sonuçlan, ilk günden sonra, 160 mikrogram/gün ve 640 mikrogram/gün siklesonid doz uygulamaları arasında alevlenme açısından istatistiksel olarak belirgin bir fark göstermiştir: 160 mikrogram/gün verilen 339 hastanın 43ünde (%12,7) ve 640 mikrogram/gün verilen 341 hastanın 23ünde (%6,7) alevlenme görülmüştür (Risk oranı: 0,523; p:0,0134). Her iki doz, 12 hafta boyunca FEVı değerleri ile karşılaştırılmıştır. 160 veya 640 mikrogram/gün siklesonid ile tedavi edilen hastaların sırasıyla %3,8 ve %5inde tedaviye bağlı istenmeyen etki gözlenmiştir. Şiddetli astım hastalarında yapılan 160, 320 ve 640 mikrogram/gün dozlarının karşılaştırıldığı bir çalışma yoktur.
12 hafta süreyle yapılan bir pediyatrik çalışmada, 160 mikrogram siklesonid/gün uygulamasında, 80 mikrogram siklesonid/gün doz uygulamasına kıyasla anlamlı olarak daha az alevlenme görülmüştür.
5.2. Farmakokinetik özellikler
Genel özellikler
Farmakokinetik karakterizasyon çoğunlukla Ml üzerinden yapılmıştır.
Emilim:
Radyoizotop ile işaretlenmiş siklesonid kullanarak yapılan oral ve intravenöz uygulamalarda oral emiliminin az olduğu (%24.5) gösterilmiştir. Siklesonid ve aktif metabolitinin oral biyoyararlanımları ihmal edilebilir düzeydedir (siklesonid < %0.5; metabolit < %1). y-sintigrafı yöntemi ile yapılan bir ölçüm ile sağlıklı gönüllülerin akciğer dokusundaki birikiminin, alınan dozun %52si oranında olduğu gösterilmiştir. Siklesonidin ölçülü doz inhalasyon uygulaması sonrasında aktif metabolitin sistemik biyoyararlammı %50nin üzerindedir. Aktif metabolitin oral biyoyararlanımmın %1in altında olması nedeniyle inhale edilen siklesonidin ağızdan yutulan kısmının sistemik emilime herhangi bir katkısı yoktur.
Dağılım:
Sağlıklı gönüllülere intravenöz yoldan uygulanan siklesonidin başlangıç dağılım aşamasının hızlı olduğu saptanmıştır; bu durum, ilacın yüksek lipofılik özelliğiyle de uyumludur. Dağılım hacminin ortalama değeri 2.9 L/kgdir. Siklesonidin total serum klerensi ilacın hepatik ekstraksiyonunun yüksek olduğuna işaret etmektedir (ortalama 2.0 L/sa/kg). Siklesonid ve aktif metaboliti neredeyse tamamen plazma proteinlerine bağlanmaktadır (%98-99).
Biyotransformasvon:
Siklesonid, akciğer dokusunda esteraz enzimleri aracılığıyla hidrolize edilerek biyolojik aktif metabolitine dönüştürülür. İnsan karaciğer mikrozomlarında uğradığı daha ileri metabolizma aşamaları enzimolojik olarak incelendiğinde, bu bileşiğin de daha sonra CYP3A4 tarafından katalizlenen inaktif hidroksillenmiş metabolitlere dönüştüğü saptanmıştır. Akciğerde ayrıca aktif metabolite ait reversibl lipofılik yağ asidi ester bileşiklerinin varlığı da saptanmıştır.
Eliminasyon:
Oral ve intravenöz uygulama sonrasında siklesonidin vücuttan esasen dışkı ile (%67) atıldığı ve atılımdaki esas yolun safra sistemi olduğu gösterilmiştir.
Doğrusallık/Doğrusal olmayan durum:
Farmakokinetiği lineerdir. Önerilen tedavi dozlarında; sistemik maruziyeti dozla orantılı artış gösterir.
Hastalardaki karekteristik özellikler
Böbrek yetmezliği:
Aktif metabolitin böbrek yoluyla atılımı söz konusu olmadığından, böbrek yetmezlikli hastalar ile çalışma yapılmamıştır.
Karaciğer yetmezliği:
Karaciğer fonksiyonundaki azalma kortikosteroidlerin vücuttan atıhmım etkileyebilir. Sirotik hastalann da katılmış olduğu bir çalışmada aktif metabolitin sistemik maruziyetinde artış gözlenmiştir.
Geriyatrik popülasyon:
Geniş çaplı toplumsal çalışmalarda saptanan farmakokinetik özelliklerinden yola çıkılarak aktif metabolitin sistemik maruziyetinde yaş faktörünün etkisi bulunmadığı ortaya konmuştur.
Diğer:
Astımlı hastalar:
5.3. Klinik öncesi güvenlilik verileri
Güvenilirlik farmakolojisi, kronik toksisite, genotoksisite ile karsinojenik potansiyel gibi geleneksel çalışmalardan elde edilen preklinik veriler, siklesonid kullanımının insan için hiçbir özel tehlikesi olmadığını ortaya çıkartmıştır.
Üreme toksisitesi için yapılan hayvan çalışmalarında glukokortikosteroidlerin yarık damak, iskelet malformasyonları gibi etkilerine rastlanmıştır. Ancak, bu sonuçların insanlara önerilen dozlarda oluşabilmesi mümkün görünmemektedir.
Köpekler ile yapılan 12 ay süren iki çalışmada, en yüksek dozların yumurtalıklar üzerinde tedaviye bağlı etkiler (atrofı) oluşturduğu gözlenmiştir. Bu etkiler, 160 mikrogramlık günlük dozun 5,27-8,34 katının sistemik maruziyeti sonucu meydana gelmiştir. Bu bulguların insanlar ile ilişkisi bilinmemektedir.
Diğer glukokortikoid türevleri ile yapılan hayvan çalışmalarında gebelik sırasında ve farmakolojik dozlardaki kullanımlarında glukokortikoidlerin intrauterin büyüme geriliği, erişkinlikte karşılaşılan kalp-damar ve/veya metabolik hastalık ile glukokortikoid reseptör yoğunluğunda değişim, nörotransmiter üretimi ve davranış bozukluğu gibi riskleri arttı r ab ildiği gösterilmiştir. Bu verilerin insanlara inhalasyon yoluyla uygulanan siklesonid ile ilintisi hakkında bilgi mevcut değildir.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
6.2. Geçimsizlikler
Bilinen geçimsizliği yoktur.
6.3. Raf ömrü
6.4. Saklamaya yönelik özel tedbirler
6.5. Ambalajın niteliği ve içeriği
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller Tıbbi Atıkların Kontrolü Yönetmeliği ve Ambalaj ve Ambalaj Atıklarının Kontrolü Yönetmeliklerine uygun olarak imha edilmelidir.