| Kullanma Talimatı | Nedir Ne İçin Kullanılır |
| Nasıl Kullanılır | Yan Etkileri |
| Eş Değerleri | Dikkat Edilmesi Gerekenler |
| Kısa Ürün Bilgisi | Prospektus |
Kısa Ürün Bilgisi
1. BEŞERİ TIBBİ ÜRÜNÜN ADI
AUGMENTIN 400mg/57mg oral süspansiyon hazırlamak için kuru toz içeren saşe
2. KALİTATİF VE KANTİTATİF BİLEŞİM
Her saşe içerisinde:
Amoksisilin (Amoksisilin trihidrat olarak).............................. 400 mg
Klavulanik asit (Potasyum klavulanat olarak).........................57 mg
Her saşe içerisinde:
Aspartam................................................................................. 10.97 mg
Yardımcı maddeler için 6.1.e bakınız.
3. FARMASÖTİK FORMU
Oral süspansiyon için toz içeren saşe.
Sulandırıldığında kirli beyaz renkte bir süspansiyon oluşur.
4.1. Terapötik endikasyonlar
AUGMENTIN, lokal resmi antibiyotik reçeteleme kılavuzları ve duyarlılık verilerine uygun olarak kullanılmalıdır.
AUGMENTIN, aşağıdaki sistemlerde amoksisiline dirençli beta laktamaz üreten suşların neden olduğundan şüphelenilen bakteriyel enfeksiyonların kısa süreli tedavisinde endikedir. Diğer durumlarda sadece amoksisilin düşünülmelidir.
Amoksisiline duyarlı organizmaların AUGMENTINe duyarlı beta-laktamaz üreten organizmalar ile birlikte neden olduğu karma enfeksiyonlar AUGMENTIN ile tedavi edilebilir. Bu enfeksiyonlar beta laktamazlara dirençli başka bir antibiyotiğin ilave edilmesini gerektirmez.
Duyarlı organizmaların listesi Farmakolojik Özellikleri/Mikrobiyoloji bölümünde verilmiştir (bknz. Bölüm 5.1).
AUGMENTINe duyarlılık, coğrafya ve zamana göre değişecektir. Mevcut ise lokal duyarlılık verilerine danışılmalı ve gerektiğinde mikrobiyolojik örnekleme ve duyarlılık testleri yapılmalıdır.
4.2. Pozoloji ve uygulama şekli
Pozoloji
40 kgın altındaki çocuklarda AUGMENTIN 400mg/57mg oral süspansiyon hazırlamak için kuru toz içeren saşe aşağıda önerilen şekilde uygulandığında maksimum 1000-2800 mg amoksisilin/143-400 mg klavulanik asit sağlar.
40 kgın altındaki çocuklar:
Çocuklar AUGMENTIN tablet, süspansiyon veya pediyatrik saşe ile tedavi edilebilir.
Tavsiye edilen genel günlük doz:
Hafif ve orta şiddetteki enfeksiyonlarda (tekrarlayan tonsillit gibi üst solunum yolu enfeksiyonları, alt solunum yolu enfeksiyonları, deri ve yumuşak doku enfeksiyonları) 25/3.6 mg/kg/gün, günde 2 doza bölünmüş halde kullanılır.
Daha ciddi enfeksiyonların tedavisi için (otitis media ve sinüzit gibi üst solunum yolu enfeksiyonları, bronkopnömoni gibi alt solunum yolu enfeksiyonları ve idrar yolları enfeksiyonları) 45/6.4 mg/kg/gün, günde 2 doza bölünmüş halde kullanılır.
Bazı enfeksiyonlarda (otitis media, sinüzit ve alt solunum yolu enfeksiyonları gibi) 70 mg/10 mg/kg/gün şeklinde günde 2 doz kullanılması değerlendirilebilir.
Uygulama sıklığı ve süresi:
Günde 2 kez alınır. Tedavi süresi, endikasyona uygun olmalı ve tedavi gözden geçirilmeden 14 günü aşmamalıdır.
|
Yaş |
Ağırlık |
Doz |
|
2 yaş - 6 yaş |
13-21 kg |
Her 12 saatte 1 saşe |
|
7 yaş - 12 yaş |
22-40 kg |
Her 12 saatte 2 saşe |
Uygulama şekli:
Oral kullanım içindir. Gastrointestinal intolerans potansiyelini en aza indirmek için yemek başlangıcında alınmalıdır. AUGMENTINin absorpsiyonu yemek başlangıcında alındığında optimum seviyededir. Tedaviye parenteral olarak başlanıp oral olarak devam edilebilir.
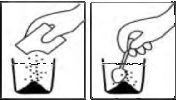
Süspansiyonun Hazırlanması:
AUGMENTIN 400mg/57mg oral süspansiyonu hazırlamak için saşe içeriğini bir miktar su içerisine azar azar ilave ederek ve karıştırarak çözünüz.
Özel popülasyonlara ilişkin ek bilgiler:
Böbrek yetmezliği:
Kreatinin klerensi 30 ml/dakmn üzerinde olan hastalarda doz ayarlamasına gerek yoktur. Kreatinin klerensi 30 ml/dakmn altında olan hastalarda doz ayarlaması için herhangi bir tavsiye olmadığından AUGMENTIN kullanımı tavsiye edilmemektedir.
Karaciğer yetmezliği:
Karaciğer bozukluğu olan hastalarda doz ayarlaması dikkatli yapılmalı ve düzenli aralıklarla karaciğer fonksiyonları izlenmelidir. Henüz doz ayarlamasına temel teşkil edecek yeterli veri bulunmamaktadır (bakınız bölüm 4.3 ve 4.4).
Pediyatrik popülasyon:
Böbrek fonksiyonu gelişmemiş olan bebeklerde AUGMENTIN kullanımı tavsiye edilmemektedir.
Geriyatrik popülasyon:
AUGMENTIN 400mg/57mg oral süspansiyon hazırlamak için kuru toz içeren saşenin geriyatrik hastalarda kullanımı tavsiye edilmez.
4.3. Kontrendikasyonlar
Sefalosporin, karbapenem veya monobaktam gibi diğer beta-laktamlara karşı şiddetli aşırı duyarlılık hikayesi (örn: anaflaksi) olanlarda kontrendikedir.
Geçmişinde AUGMENTINe bağlı sarılık/karaciğer fonksiyon bozukluğu hikayesi olan hastalarda kontrendikedir (bakınız bölüm 4.8).
4.4. Özel kullanım uyarıları ve önlemleri
AUGMENTIN ile tedaviye başlanılmadan önce geçmişte penisilin, sefalosporin ve diğer beta laktam ajanlara karşı aşırı duyarlılık hikayesi varlığı dikkatlice sorgulanmalıdır (bakınız bölüm 4.3 ve 4.8).
Penisilin tedavisi alan hastalarda ciddi ve bazen öldürücü aşırı duyarlılık (anafılaktoid) reaksiyonları bildirilmiştir. Bu reaksiyonların geçmişinde penisiline karşı aşırı duyarlılık hikayesi olan ve atopik bireylerde görülmesi daha olasıdır. Eğer alerjik bir reaksiyon gözlenirse, AUGMENTIN tedavisi kesilmeli ve uygun alternatif tedavi uygulanmalıdır.
Klavulanik asit ile inhibisyona duyarlı beta laktamazların aracılık etmediği beta laktam ajanlara dirençli olası patojenlere dair yüksek risk olduğunda AUGMENTIN 400mg/57mg saşe kullanım için uygun değildir. AUGMENTIN 400mg/57mg saşe, penisiline dirençli
S.pneumoniae tedavisinde kullanılmamalıdır.
Böbrek yetmezliği olan veya yüksek doz alan hastalarda konvülsiyonlar gözlenebilir (bakınız bölüm 4.8).
Amoksisilin kullanımını takiben görülen kızamık benzeri döküntü, enfeksiyöz mononükleoz ile ilişkili olabileceğinden eğer enfeksiyöz mononükleoza ilişkin bir şüphe var ise AUGMENTIN tedavisinden kaçınılmalıdır.
Tedavi sırasında allopurinolün birlikte kullanılması alerjik deri reaksiyonları riskini artırabilir.
Tedavi başlangıcında püstül ile ilişkili ateşli jeneralize eritema gözlenmesi, akut jeneralize egzantemli püstüloz (AGEP) belirtisi olabilir (bakınız bölüm 4.8). Bu reaksiyon AUGMENTIN tedavisinin kesilmesi gerektirir ve sonradan herhangi bir amoksisilinin uygulanması kontrendikedir.
Uzun süreli kullanım zamanla duyarlı olmayan organizmaların aşırı çoğalmasına neden olabilir.
AUGMENTIN kullanan bazı hastalarda karaciğer fonksiyon testlerinde değişiklikler gözlenmiştir. Bu değişikliklerin klinik önemi bilinmemektedir; ancak karaciğer fonksiyon bozukluğu bulgusu olan hastalarda AUGMENTIN dikkatli kullanılmalıdır.
Seyrek olarak bildirilmiş kolestatik sarılık şiddetli olmakla birlikte genellikle geri dönüşümlüdür. Tedavinin kesilmesinden 6 hafta sonrasına kadar bulgu ve belirtiler kaybolabilir.
Hepatik olaylar özellikle erkekler ve yaşlı hastalarda bildirilmiştir ve uzun süreli tedavi ile bağlantılı olabilir. Bu olaylar nadiren çocuklarda bildirilmiştir. Tüm popülasyonlarda, belirtiler ve semptomlar tedavi sırasında veya hemen sonrasında gözlenir fakat bazı vakalarda tedavinin üzerinden birkaç hafta geçmeden ortaya çıkmayabilir. Bu etkiler genellikle geri dönüşlüdür. Hepatik olaylar şiddetli olabilir ve çok nadir durumlarda ölümler bildirilmiştir. Bunlar neredeyse her zaman altta yatan şiddetli hastalığı olanlarda veya hepatik etkisi olduğu bilinen ilaçlarla birlikte kullanımda gözlenmiştir (bakınız bölüm 4.8).
Amoksisilin içeren neredeyse tüm antibakteriyel ajanlarla, antibiyotiğe bağlı kolit bildirilmiştir ve şiddeti hafiften yaşamı tehdit edici boyuta kadar uzanabilir (bakınız bölüm 4.8). Bu sebeple, herhangi bir antibiyotik tedavisi sırasında veya sonrasında ishal olan hastalarda bu teşhisin değerlendirilmesi önemlidir. Antibiyotiğe bağlı kolit gözlendiğinde, AUGMENTIN tedavisi derhal kesilmeli, bir doktor tarafından değerlendirilmeli ve uygun tedavi başlatılmalıdır. Bu durumda anti-peristaltik ilaçlar kontrendikedir.
Uzun süreli tedavilerde renal, hepatik ve hematopoetik fonksiyon gibi organ sistem fonksiyonlarının periyodik değerlendirilmesi önerilmektedir.
AUGMENTIN ve oral antikoagülan kullanan bazı hastalarda seyrek olarak protrombin zamanında uzama (INR değerinde yükselme) bildirilmiştir. Antikoagülanlar ile birlikte reçete edildiğinde uygun şekilde izlenmesi gereklidir. İstenilen antikoagülasyon düzeyini sürdürebilmek için oral antikoagülan dozunda ayarlama yapılması gerekebilir (bakınız bölüm
4.5 ve 4.8).
Böbrek yetmezliği olan hastalarda, yetmezliğin derecesine göre doz ayarlanmalıdır (bakınız bölüm 4.2).
Azalmış idrar çıkışı olan hastalarda, özellikle parenteral tedavide çok seyrek olarak kristalüri görülmüştür. Yüksek doz amoksisilin tedavisi sırasında, amoksisilin kristalüri olasılığını azaltmak için uygun miktarda sıvı alınması ve idrar miktarının düzenlenmesi tavsiye edilebilir Mesane kateteri olan hastalarda, açıklık düzenli olarak kontrol edilmelidir, (bkz. bölüm 4.9).
Amoksisilin ile tedavi sırasında, non enzimatik metotlarla yalancı pozitif sonuçlar gözlenebildiği için idrarda glukoz varlığı için test yapıldığında enzimatik glukoz oksidaz metotları kullanılmalıdır.
AUGMENTINde klavulanik asit varlığı, kırmızı hücre membranları ile IgG ve albumine non spesifik bağlanmaya neden olabilir ve yalancı pozitif Coombs testine sebep olur.
Sonrasında Aspergillus enfeksiyonu olmadığı bulunan amoksisilin/klavulanik asit alan hastalarda Bio-Rad Laboratuarları Aspergillus EIA testi kullanıldığında pozitif test sonuçlan bildirilmiştir. Bio-Rad Laboratuarları Aspergillus EIA testi ile non Aspergillus polisakkaritleri ve polifuranlar arasında çapraz reaksiyon bildirilmiştir. Bu sebeple, AUGMENTIN alan hastalarda pozitif test sonuçları dikkatle yorumlanmak ve diğer tanı metotlan ile doğrulanmak dır.
Her saşede 11.0 mg aspartam bulunur. Aspartam fenilalanin içerir. Fenilketonürisi olan insanlar için zararlı olabilir. Fenilketonüri hastalan, fenilalaninin zararlı olabileceği konusunda bilgilendirilmelidir.
AUGMENTIN 400mg/57mg oral süspansiyon hazırlamak için kuru toz içeren saşenin formülasyonunda yer alan tatlandıncılar maltodekstrin (glukoz) içerir. Nadir kalıtımsal galaktoz intoleransı, Lapp laktoz yetmezliği ya da glukoz - galaktoz malabsorpsiyon problemi olan hastaların bu ilacı kullanmamaları gerekir.
4.5 Diğer tıbbi ürünlerle etkileşimler ve diğer etkileşim şekilleri
Probenesid
Probenesid ile birlikte kullanımı önerilmemektedir. Probenesid amoksisilinin renal tübüler sekresyonunu azaltır. Probenesidin AUGMENTIN ile birlikte kullanımı amoksisilinin kan seviyelerinin artışına ve kanda bulunma süresinin uzamasına neden olabilirken, klavulanatı etkilemez.
Allopurinol
Amoksisilin tedavisi sırasında allopurinol kullanımı alerjik cilt reaksiyonları olasılığını artırabilir. Allopurinol ve AUGMENTINin birlikte kullanımına ait veri yoktur.
Oral kontraseptifler
Diğer antibiyotiklerde de olduğu gibi AUGMENTIN, barsak florasını etkileyebilir, östrojen reabsorbsiyonunun azalmasına yol açar ve kombine oral kontraseptiflerin etkinliğini azaltır.
Oral antikoagülanlar
Oral antikoagülanlar ve penisilin türevi antibiyotikler pratikte herhangi bir etkileşim rapor edilmeksizin yaygın olarak kullanılmıştır. Fakat, literatürde asenokumarol veya warfarin kullanan ve amoksisilin tedavisi verilen bazı hastalarda INR değerinde yükselme görüldüğü seyrek vakalar mevcuttur. Eğer bu birlikte kullanım gerekli ise, AUGMENTIN kullanımı veya bırakılması sürecinde protrombin zamanı veya INR değeri dikkatle izlenmelidir. Ayrıca, oral antikoagülanların dozunun yeniden ayarlanması gerekebilir (bakınız bölüm 4.4 ve 4.8).
Metotreksat
Penisilinler metotreksat atıhmım azaltabilir ve toksisitede olası bir artışa neden olur.
Özel popülasyonlara ilişkin ek bilgiler
Veri bulunmamaktadır.
Pediyatrik popülasyon:
Yukarıda verilen bilgiler pediyatrik popülasyon için geçerlidir.
4.6. Gebelik ve laktasyon
Genel tavsiye
Gebelik Kategorisi: B
Çocuk doğurma potansiyeli bulunan kadınlar/Doğum kontrolü (Kontrasepsiyon)
Diğer antibiyotiklerde de olduğu gibi AUGMENTIN, barsak florasını etkileyebilir, östrojen reabsorpsiyonunun azalmasına yol açar ve kombine oral kontraseptiflerin etkililiğini azaltır. Bu nedenle tedavi süresince alternatif, etkili ve güvenilir bir doğum kontrol yöntemi uygulanmalıdır.
Gebelik dönemi
Gebe kadınlara verilirken dikkatli olunmalıdır.
Sınırlı sayıda gebelikte maruz kalma olgularına ilişkin veriler, AUGMENTINin gebelik üzerinde ya da fetusun/yeni doğan çocuğun sağlığı üzerinde advers etkileri olduğunu göstermemektedir. Bugüne kadar herhangi önemli bir epidemiyolojik veri elde edilmemiştir. Hayvanlar üzerinde yapılan çalışmalar, gebelik / embriyonal /fetal gelişim / doğum ya da doğum sonrası gelişim ile ilgili olarak doğrudan ya da zararlı etkiler olduğun göstermemektedir (bkz. Bölüm 5.3).
Preterm, fetal membran yırtılması (pPROM) olan kadınlarda yapılan bir çalışmada, AUGMENTINin profılaktik kullanımının yeni doğanlarda nekroze enterokolit riskinin
artması ile ilişkili olabileceği bildirilmiştir. Tüm ilaçlarda olduğu gibi, doktor tarafından gerekli görülmedikçe gebelik esnasında özellikle gebeliğin ilk üç ayında kullanılmamalıdır.
Laktasyon dönemi
AUGMENTINin iki etkin maddesi de anne sütüne geçer (klavulanik asidin anne sütü ile beslenen yeni doğanda etkilerine dair bir şey bilinmemektedir). Bu nedenle, anne sütü ile beslenen yeni doğanda diyare ve mükoz membranlarda mantar enfeksiyonu görülebilir, bu nedenle emzirmeye ara verilmelidir. AUGMENTIN, sadece fayda/risk değerlendirmesi doktor tarafından yapıldıktan sonra laktasyon döneminde kullanılabilir.
Üreme yeteneği / Fertilite
Oral ve parenteral yolla verildiği hayvanlar (fare ve sıçanlar) üzerinde yapılan reprodüktif çalışmalarda, AUGMENTIN teratojenik etki göstermemiştir.
4.7. Araç ve makine kullanımı üzerindeki etkiler
4.7. Araç ve makine kullanımı üzerindeki etkiler
ine dair herhangi bir çalışma yapılmamıştır. Fakat, araç ve makine kullanımını etkileyebilecek istenmeyen etkiler (örn: alerjik reaksiyonlar, sersemlik, konvülsiyon) ortaya çıkabilir (bakınız bölüm 4.8).
En sık bildirilen istenmeyen etkiler diyare, bulantı ve kusmadır.
Çok yaygın görülenlerden seyrek görülenlere kadar, istenmeyen etkilerin görülme sıklığını saptamak için geniş çaplı klinik çalışmaların verileri kullanılmıştır. Diğer istenmeyen etkilere (1/10.000den az görülenler) ait sıklıklar pazarlama sonrası verilere göre saptanmıştır ve gerçek bir sıklıktan çok raporlama oranına dayanmaktadır.
Med DRA Sistem Organ Sınıfına göre sıklık sınıflandırması aşağıdaki gibidir:
Çok yaygın > 1/10 Yaygın > 1/100 ila < 1/10 Yaygın olmayan >1000 ila < 1/100 Seyrek >1/10.000 ila < 1/1000 Çok seyrek < 1/10.000
Bilinmiyor (mevcut verilerden tahmin edilemiyor)
Enfeksiyonlar ve enfestasyonlar
Yaygın: Mukokutanöz kandi diyazi s.
Bilinmiyor: Duyarlı olmayan organizmaların aşırı çoğalması
Kan ve lenf sistemi bozukluklan
Seyrek: Geri dönüşümlü lökopeni (nötropeni dahil) ve trombositopeni.
Çok seyrek: Geri dönüşümlü agranülositoz ve hemolitik anemi. Kanama ve protrombin
zamanında uzama (Bölüm 4.4e bakınız.).
Bağışıklık sistemi bozuklukları
Çok seyrek: Anjiyonörotik ödem, anafılaksi, serum hastalığı benzeri sendrom, aşırı
duyarlılık vasküliti (Bölüm 4.4e bakınız.).
Sinir sistemi bozuklukları:
Yaygın olmayan: Baş dönmesi, baş ağrısı.
Çok seyrek: Geri dönüşümlü hiperaktivite ve konvülziyonlar. Konvülziyonlar renal
fonksiyon bozukluğu olanlarda veya yüksek doz alanlarda görülebilir (Bölüm 4.4e bakınız.).
Gastrointestinal bozukluklar:
Yaygın: Diyare, bulantı, kusma.
Bulantı sıklıkla yüksek oral dozlar ile ilişkilidir. Eğer gastrointestinal reaksiyonlar görülür ise, AUGMENTIN yemek başlangıcında alınarak bunlar azaltılabilir.
Yaygın olmayan: Sindirim güçlüğü.
Çok seyrek: Antibiyotiğe bağlı kolit (psödomembranöz kolit ve hemorajik kolit dahil).
Dildeki papillaların belirginleşip siyah renk alması, dişlerde renk değişimi.
Çocuklarda çok seyrek olarak yüzeyel diş rengi değişikliği bildirilmiştir. Genellikle fırçalama ile giderildiğinden, iyi bir ağız hijyeni ile diş rengi değişimi engellenebilir.
Hepato-bilier bozukluklar:
Yaygın olmayan: Beta-laktam sınıfı antibiyotiklerle tedavi edilen hastalarda AST ve/veya
ALT değerlerinde orta derecede artış görülmüştür; ancak bu bulguların önemi bilinmemektedir.
Çok seyrek: Hepatit ve kolestatik sarılık. Bu olaylar diğer penisilin ve sefalosporinlerle
bildirilmiştir.
Hepatik olaylar çoğunlukla erkeklerde ve yaşlılarda bildirilmiştir ve uzun süreli tedavi ile ilişkili olabilir. Bu olaylar çocuklarda çok seyrek olarak bildirilmiştir.
Bulgu ve belirtiler genellikle tedavi sırasında veya tedavi kesildikten kısa bir süre sonra görülür; ancak bazı durumlarda tedavi kesildikten birkaç hafta sonrasına kadar
farkedilmeyebilir. Bunlar genellikle geri dönüşümlüdür. Hepatik olaylar şiddetli olabilir ve son derece seyrek olmakla birlikte bu duruma bağlı ölüm bildirilmiştir. Bunlar hemen hemen her zaman altta yatan ciddi bir hastalığı olan ya da hepatik etki potansiyeline sahip ilaçları aynı anda alan hastalarda görülmüştür.
Deri ve deri altı doku bozuklukları:
Yaygın olmayan: Deride döküntü, kaşıntı, ürtiker.
Seyrek: Eritema multiforme.
Çok seyrek: Stevens-Johnson sendromu, toksik epidermal nekrolizis, bülloz döküntülü
dermatit ve akut generalize ekzantemöz püstüller (AGEP) (Bölüm 4.3e bakınız).
Eğer herhangi bir aşırı duyarlılık dermatiti görülürse tedavi kesilmelidir (Bölüm 4.4e bakınız).
Böbrek ve idrarla ilgili bozukluklar:
Seyrek: Hematüri
4.9. Doz aşımı ve tedavisi
4.9. Doz aşımı ve tedavisi
Semptomlar ve doz aşımı belirtileri
Gastrointestinal semptomlar ve sıvı ile elektrolit dengesinin bozulması açıkça görülebilir. Bazı olgularda, böbrek yetmezliğine yol açan amoksisilin kristalürisi görülmüştür (Bölüm 4.4e bakınız).
Böbrek fonksiyonu bozulmuş hastalarda ve yüksek doz alanlarda konvülsiyonlar ortaya çıkabilir.
Amoksisilinin özellikle yüksek dozların intravenöz uygulamasından sonra mesane kateterlerinde çöktüğü bildirilmiştir. Açıklığın düzenli olarak kontrol edilmesi gerekir (Bölüm 4.4e bakınız).
Tedavi
Gastrointestinal semptomlar, su elektrolit dengesine dikkat edilerek semptomatik olarak tedavi edilebilir.
AEIGMENTIN dolaşımdan hemodiyaliz ile uzaklaştırılabilir.
Zehir kontrol merkezinde yapılan 51 pediatrik hastanın katıldığı prospektif bir çalışma amoksisilinin 250 mg/kgdan daha düşük aşırı dozlarının anlamlı klinik belirtilerle ilişkili olmadığını ve midenin yıkanmasını gerektirmediğini göstermiştir.
5. FARMAKOLOJİK ÖZELLİKLER
5.1. Farmakodinamik özellikler
Farmakoterapötik grup: Beta laktamaz inhibitörlerini içeren penisilin kombinasyonları ATC kodu: J01CR02
Etki mekanizması
Amoksisilin, bakteriyel hücre duvarının ayrılmaz bir yapısal unsuru olan bakteriyel peptidoglikanın biyosentez yolaklarındaki enzimlerin (sıklıkla penisilin bağlayıcı proteinler olarak adlandırılır, PBP [penicillin-binding proteins]) bir ya da daha fazlasını inhibe eden bir yarı sentetik penisilindir (beta-laktam antibiyotik). Peptidoglikan sentezinin inhibisyonu hücre duvarının zayıflamasına yol açar ve genellikle bunu, hücrelerde yıkım (lizis) ile ölüm izler.
Amoksisilin, dirençli bakterilerin ürettiği beta laktamazlar tarafından bozunmaya duyarlıdır ve bu yüzden, tek başına amoksisilinin aktivite spektrumu bu enzimleri üreten mikroorganizmaları kapsamaz.
Klavulanik asit, yapısal olarak pensilinlerle bağlantılı bir beta laktamdır. Bazı beta laktamaz enzimleri inaktive ettiğinden amoksisilinin inaktivasyonunu önler. Tek başına klavulanik asit klinik açıdan yararlı bir antibakteriyel etki göstermez.
Farmakodinamik etkiler:
Organizmalar, amoksisilin/klavulanata karşı in vitro duyarlılıklarına göre aşağıda kategorize edilmektedir.
Klinik çalışmalarda amoksisilin-klavulanatın klinik etkililiği kanıtlanmışsa, bu durum bir yıldız işareti (*) ile gösterilmektedir.
Beta-laktamaz üretmeyen organizmalar (f) işareti ile tanımlanmıştır. Bir izolatın amoksisiline karşı duyarlı olması durumunda, amoksisilin/klavulanata karşı da duyarlı olduğu düşünülebilir.
Genellikle duvarlı türler
Aerobik Gram-pozitif mikroorganizmalar Bacillius anthracis Enterococcus faecalis Listeria monocytogenes Nocardia asteroides
Staphylococcus aureus (metisiline duyarlı)*
Streptococcus agalactiae*^
Streptococcus pyogerıes*^ ve diğer beta hemolitik streptokoklar*^
Streptococcus viridarıs grubu
Staphylococcus saprophyticus (meti siline duyarlı)
Koagülaz negatif stafılokoklar (metisiline duyarlı)
Aerobik Gram-negatif mikroorganizmalar Bordetella pertussis Haemophilus influenzae1 Haemophilus parainfluenzae Helicobacter pylori Moraxella catarrhalis Neisseria gorıorrhoeae Pasteurella multocida Vibrio cholera
Diğer
Borrelia burgdorferi Leptospira ictterohaemorrhagiae Treponema pallidum
Anaerobik Gram-pozitif mikroorganizmalar Clostridium türleri Peptococcus rıiger Peptostreptococcus magnus Peptostreptococcus micros Peptostreptococcus türleri
Anaerobik Gram-negatif mikroorganizmalar Bacteroides fragilis Bacteroides türleri Capnocytophaga türleri Eikenella corrodens Fusobacterium nucleatum Fusobacterium türleri Porphyromonas türleri
Prevotella türleri_
Edinilmiş direncin bir sorun oluşturabileceği türler
Aerobik Gram-negatif mikroorganizmalar
Escherichia coli
Klebsiella oxytoca
Klebsiella pneumoniae
Klebsiella türleri
Proteus mirabilis
Proteus vulgaris
Proteus türleri
Salmonella türleri
Shigella türleri
Aerobik Gram-pozitif mikroorganizmalar Corynebacterium türleri Enlerococcus fcıecium1_
Aerobik Gram-negatif mikroorganizmalar
Acinetobacter türleri
-T~2-
Streptococcus pneumoniae* Viridarıs grup streptococcus^_
Citrobacter freundii
Enterobacter türleri
Hafnia alvei
Legionella prıeumophüa
Morganella morganii
Providencia türleri
Pseudomorıas türleri
Serratia türleri
Stenotrophomonas maltophilia Yersirıia enterolitica
Diğer mikroorganizmalar Chlamydophüa pneumoniae Chlamydophila psittaci Chlamydia türleri Coxiella burnetii Mycoplasma pneumoniae
Mycoplasma türleri_
Edinilmiş direnç mekanizmasının yokluğunda orta düzeyde doğal duyarlılık B Metisiline dirençli tüm stafılokoklar amoksisilin/klavulanik asite dirençlidir.
1 Bazı AB ülkelerinde duyarlılığı azalmış suşlar, %10dan daha yüksek bir sıklıkta bildirilmiştir.
5.2. Farmakokinetik özellikler
Genel özellikler:
Emilim:
Hem amoksisilin hem de klavulanik asit, fizyolojik pHda sulu çözeltilerde tamamen ayrılır. Her iki bileşik de oral uygulama sonrası hızla ve iyi absorbe olur. AUGMENTINin absorpsiyonu yemek başlangıcında alındığında optimum seviyeye ulaşır. Oral yolla verilişi takiben AUGMENTINin biyoyararlanımı %70e ulaşır. Her iki bileşene ait plazma profilleri benzer olup doruk plazma konsantrasyonu (Tmaks) her ikisi için de yaklaşık bir saattir.
Yapılan bir çalışmanın sonuçlarına göre, sağlıklı erişkinlerde aç kamına AUGMENTIN 875/125 mg tabletin günde iki kere uygulanması sonucunda aşağıdaki sonuçlar elde edilmiştir.
|
Ortalama (±SS) farmakokinetik parametreler |
|||||
|
Uygulanan etkin |
Doz |
Cmaks |
Tmaks* |
EAA(o_24sa) |
Tl/2 |
|
madde(ler) |
(mg) |
(pg/ml) |
(sa) |
(pg.sa/ml) |
(sa) |
|
Amoksisilin |
|||||
|
A M K/K A |
875 |
11.64 |
1.50 |
53.52 |
1.19 |
|
875mg/125mg |
±2.78 |
(1.0-2.5) |
±12.31 |
±0.21 |
|
|
Klavulanik asit |
|||||
|
A M K/K A |
125 |
2.18 |
1.25 |
10.16 |
0.96 |
|
875mg/125mg |
±0.99 |
(1.0-2.0) |
±3.04 |
±0.12 |
|
|
AMK: Amoksisilin, KA: Klavulanik asit |
|||||
|
*Ortanca |
|||||
Amoksisilin/klavulanik asit ile elde edilen amoksisilin ve klavulanik asit serum konsantrasyonları, amoksisilin ve klavulanik asitin tek başlarına oral yolla verilişi ile elde edilen konsantrasyonlarla benzerlik göstermektedir.
Dağılım:
Toplam plazma klavulanik asidin % 25i ve toplam plazma amoksisilinin % 18i proteine bağlanmaktadır. Görünür dağılım hacmi amoksisilin için 0.3-0.4 L/kg ve klavulanik asit için
0.2 L/kgdır.
İntravenöz uygulama sonrası amoksisilin ve klavulanik asitin safra kesesi, abdominal doku, deri, yağ ve kas dokuları ile sinoviyal, peritonal sıvı, safra ve cerahatin de dahil olduğu sıvılarda terapötik seviyelerde konsantrasyonları bulunmuştur. Amoksisilin beyin-omurilik sıvısında yeterli oranda dağılmamaktadır.
Yapılan hayvan deneylerine göre, her iki bileşen için de ilaca-bağlı materyale ait belirgin bir doku tutulumunun bulunduğuna ilişkin bir kanıt bulunmamaktadır. Amoksisilin diğer bir çok penisilin gibi anne sütünde saptanabilir. Eser miktarda klavulanat da ayrıca anne sütünde tespit edilebilir (bkz. Bölüm 4.6).
Hem amoksisilin hem de klavulanik asidin plasental bariyerim- geçtiği gösterilmiştir. (Bölüm 4.6ya bakınız).
Biyotransformasvon:
Amoksisilin kısmen idrarla, başlangıç dozunun yaklaşık %10-25i oranında inaktif penisiloik asit şeklinde atılır. Klavulanik asit insanda geniş oranda 2,5-dihidro-4-(2-hidroksietil)-5-okso-lH-pirol-3-karboksilik asit ve l-amino-4-hidroksi-bütan-2-ona metabolize olarak, idrar ve feçes içinde ve karbondioksit şeklinde hava ile atılır.
Eliminasvon:
Diğer penisilinlerde olduğu gibi amoksisilinin ana atılım yolu böbreklerdir, klavulanik asid ise hem böbreklerle hem de böbrekler dışındaki mekanizmalar ile elimine edilir. Amoksisilin/klavulanik asit eliminasyon yarılanma-ömrü yaklaşık bir saattir ve ortalama toplam klerens sağlıklı deneklerde 25 L/sadir. Tek doz 250mg/125mg veya 500 mg/125 mg tablet uygulaması sonrası ilk 6 saat içinde, amoksisilinin yaklaşık % 60-70i, klavulanik asidin ise % 40-65i değişmemiş şekilde idrar ile atılır. Çeşitli çalışmalarda, amoksisilin için % 50-85 ve klavulanik asit için % 27-60 arası idrarla atılım gözlenmiştir, klavulanik asidin en fazla atılımı uygulamadan sonraki iki saat içinde gerçekleşmiştir.
Probenesid ile birlikte kullanım amoksisilin atıhmım geciktirir; fakat klavulanik asitin renal atıhmım geciktirmez {bkz. bölüm 4.5).
Hastalardaki karakteristik özellikler
Yas:
Amoksisilinin eliminasyon yanlanma ömrü 3 aylıktan 2 yaşma kadar olan çoçuklarda ve daha büyük çocuklarda aynıdır. Yaşlı hastalarda böbrek işlevlerinde azalma olasılığı daha fazla olduğundan, doz seçiminde dikkatli olunmalıdır ve böbrek işlevinin izlenmesi yararlı olabilir.
Cinsiyet:
Amoksisilin/klavulanik asitin sağlıklı erkek ve dişi deneklere oral uygulamasından sonra, amoksisilin ve klavulanik asit farmakokinetikleri üzerinde belirgin bir etki gözlenmemiştir.
Böbrek yetmezliği:
Amoksisilin/klavulanik asit toplam serum klerensi, renal fonksiyondaki bozuklukla orantılı bir şekilde azalmaktadır. İlaç klerensindeki azalma amoksisilin için, amoksisilinin daha yüksek oranda renal yolla atılmasından dolayı, klavulanik asite göre nispeten daha fazla gerçekleşmektedir. Böbrek yetmezliği durumunda dozlar dolayısıyla amoksisilinin gereksiz akümülasyonunu önleyecek biçimde ayarlanırken klavulanik asit düzeylerinin de yeterli olması sağlanmalıdır (bkz. Bölüm 4.2).
Karaciğer yetmezliği:
5.3. Klinik öncesi güvenlilik verileri
Klinik öncesi veriler, farmakoloji, genotoksisite ve üreme toksisitesine yönelik çalışmalar insanlar açısından özel bir tehlike ortaya koymamıştır.
Köpeklerde amoksisilin/klavulanik asitle yapılan tekrarlanan doz toksisitesi çalışmalarında, gastrik tahriş, kusma ve dilde renk bozukluğu görülmüştür.
AUGMENTIN ya da bileşenleriyle karsinoj eni site çalışmaları yapılmamıştır.
6. FARMASÖTİK ÖZELLİKLER
6.1. Yardımcı maddelerin listesi
Krospovidon Silikon dioksit Magnezyum stearat Aspartam
6.2. Geçimsizlikler
Bilinen bir geçimsizliği bulunmamaktadır.
6.3. Raf ömrü
6.4. Saklamaya yönelik özel tedbirler
6.5. Ambalajın niteliği ve içeriği
Kuru toz halinde 10 ve 20 saşe içeren kutularda.
6.6. Beşeri tıbbi üründen arta kalan maddelerin imhası ve diğer özel önlemler
Kullanılmamış olan ürünler ya da atık materyaller Tıbbi atıkların kontrolü yönetmeliği ve
Ambalaj ve ambalaj atıklarının kontrolü yönetmeliğine uygun olarak imha edilmelidir.